研究概要Research
現在とりくんでいる研究テーマ
私たちの研究室では、「痛みは何故、慢性化するのか?」を明らかにする研究を中心に行っています。多様な分子メカニズムが関わると予想される慢性痛の発症の仕組みをできる限り明らかにし、有用な創薬標的、いわゆる「クスリの種」となる分子を突き止めたいと日夜研究に励んでいます。脳・脊髄から構成される中枢神経系は様々な高次機能を制御しており、これらの異常が神経変性疾患や精神疾患、慢性疼痛といった疾患を引き起こすといわれています。中枢神経系はその名が示すように神経細胞が主な構成成分ですが、その他にも様々な細胞が存在しています。その一つがアストロサイトやミクログリアといったグリア細胞です。近年の研究からグリア細胞の機能異常が、多くの中枢神経疾患に関与していることが明らかになってきています。薬効科学研究室では、慢性痛に加えて、気分障害や認知機能障害といった病態におけるグリア細胞の役割をさまざまな角度から解析しています。
1) 慢性痛の分子メカニズムに迫る! 〜 臨床に近しいモデルを用いた研究 〜
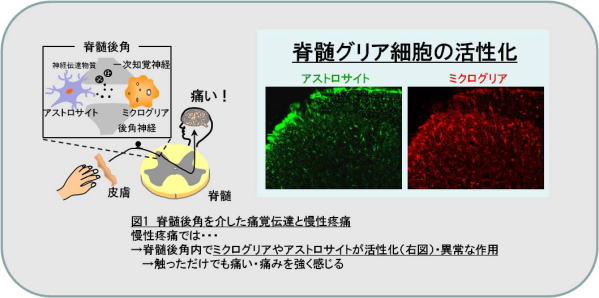
現在、身体のどこかに何かしらの痛みを抱える方が、日本で約 2,400 万人、世界では約5億人も存在します。長く続く痛み、慢性痛は非常に辛いストレスとなることから、これだけ多くの方が慢性痛を抱えているとなると、その社会的損失は計り知れません。また高齢化やストレス社会を背景に患者さんの数は今後も増加することが予想されます。慢性痛には慢性的な炎症が原因となる関節リウマチや変形関節症などの炎症性疼痛、末梢神経や中枢神経が直接損傷されることに起因する帯状疱疹後神経痛、糖尿病性疼痛などの神経障害性疼痛、組織のどこにも発痛物質や炎症は存在せず、また神経損傷も認められないにもかかわらず全身に痛みを生じる線維筋痛症や慢性腰痛などの痛覚変調性疼痛が挙げられます。これらの慢性痛はモルヒネなどのオピオイドやロキソニン・インドメタシン等の非ステロイド性抗炎症薬(NSAIDs)、プレガバリン等のガバペンチノイドといった既存の鎮痛薬が奏功しにくいといわれています。それ故、新たな作用メカニズムを有する鎮痛薬の創薬が必要不可欠です。その慢性痛治療の新たな標的として注目されているのがグリア細胞(ミクログリア・アストロサイト)です。最近の研究から、脊髄や脳に存在するグリア細胞の機能異常が慢性疼痛の惹起に関与していることが明らかとなっています(図1)。
慢性痛には「痛い」という感覚だけではなく、痛みによる「嫌な気持ち」や「辛い記憶」といった情動と認知も関わっています。また慢性痛は、気分障害や認知症を発症するリスクが高めることも報告されています。持続する痛みが強いストレスとなり、これらの高次脳機能に変化をもたらすことで痛みの慢性化や、情動異常、認知症の発症に影響を及ぼしている可能性が予想されますが、その詳細なメカニズムは明らかではありません。我々の研究から、これらにもグリア細胞が重要な働きをしていることが明らかとなってきています。
私たちの研究室では、上記の課題をできるだけ臨床像に近いモデル(動物)で研究することを念頭に、様々な動物モデルの構築・応用にも力を入れています。現在、研究室では一般的な疼痛モデルの神経障害性疼痛モデル(部分的坐骨神経結紮モデル、神経枝結紮損傷モデル)や侵害受容性疼痛モデル(ホルマリンモデル、完全アジュバントモデル)だけではなく、三叉神経ニューロパチーモデル(三叉神経の一つである遠位眼窩下神経を慢性的に狭窄損傷)、変形性膝関節症モデル(モノヨード酢酸を膝関節内に投与)、腰部脊柱管狭窄症モデル(腰部脊柱管にシリコンチューブを挿入)、糖尿病性神経障害モデル(ストレプトゾトシン投与))、線維筋痛症モデル(レセルピン投与)、パーキンソン病性疼痛モデル(線条体への6-水酸化ドパミン投与)を用いて、それぞれの病態発症に関わる分子を個別に解析することで、より臨床に近しい知見が得ることを目指しています。
慢性痛には「痛い」という感覚だけではなく、痛みによる「嫌な気持ち」や「辛い記憶」といった情動と認知も関わっています。また慢性痛は、気分障害や認知症を発症するリスクが高めることも報告されています。持続する痛みが強いストレスとなり、これらの高次脳機能に変化をもたらすことで痛みの慢性化や、情動異常、認知症の発症に影響を及ぼしている可能性が予想されますが、その詳細なメカニズムは明らかではありません。我々の研究から、これらにもグリア細胞が重要な働きをしていることが明らかとなってきています。
私たちの研究室では、上記の課題をできるだけ臨床像に近いモデル(動物)で研究することを念頭に、様々な動物モデルの構築・応用にも力を入れています。現在、研究室では一般的な疼痛モデルの神経障害性疼痛モデル(部分的坐骨神経結紮モデル、神経枝結紮損傷モデル)や侵害受容性疼痛モデル(ホルマリンモデル、完全アジュバントモデル)だけではなく、三叉神経ニューロパチーモデル(三叉神経の一つである遠位眼窩下神経を慢性的に狭窄損傷)、変形性膝関節症モデル(モノヨード酢酸を膝関節内に投与)、腰部脊柱管狭窄症モデル(腰部脊柱管にシリコンチューブを挿入)、糖尿病性神経障害モデル(ストレプトゾトシン投与))、線維筋痛症モデル(レセルピン投与)、パーキンソン病性疼痛モデル(線条体への6-水酸化ドパミン投与)を用いて、それぞれの病態発症に関わる分子を個別に解析することで、より臨床に近しい知見が得ることを目指しています。
・慢性疼痛におけるHMGB1
.jpg)
High mobility group box-1 (HMGB-1) は細胞核内に存在し、普段は遺伝子複製などに関与するタンパク質ですが、細胞が刺激される、または死滅するなどにより、細胞外に遊離あるいは漏出し、炎症性物質として作用します。最近の研究から様々な炎症性疾患(敗血症、脳卒中、循環器系疾患、糖尿病、関節リウマチ、がんなど)の発症に関係していることが分かってきました。私たちはこのHMGB1と慢性疼痛の関係に着目して研究を行ってきました(Biochem. Pharmacol., 2024)。その結果、坐骨神経損傷により発症させた神経障害性疼痛モデルにおいて、脊髄後角や傷害した神経周囲においてHMGB1量が増加していることを見出しました(PLoS One, 2013; J. Neurochem., 2016、図2; J. Neurochem., 2019)。またHMGB1に対する中和抗体(HMGB1をトラップする作用)を投与すると、痛みが軽減することが示され、HMGB1が慢性疼痛の重要な因子の一つであることが明らかとなりました。最近の研究から、坐骨神経で増加したHMGB1は知覚神経を刺激することで、脊髄後角でのグルタミン酸を介した情報伝達を亢進し、同部位に存在するミクログリアを活性化させ、痛みを惹起させていることも報告しました(Biochem. Pharmacol., 2021)。
三叉神経ニューロパチー と HMGB1
三叉神経ニューロパチーは、親知らずの抜歯などの歯科治療時に、三叉神経の損傷によって誘発される慢性疼痛です。現在、有効な治療法は存在しておらず、新たな治療薬・治療戦略の開発が課題となっています。我々は、三叉神経が物理的に損傷される際に、HMGB1 が細胞外へ漏出し慢性疼痛を発症させるトリガーとなる可能性に着目しました。各種検討の結果、神経損傷直前にHMGB1機能を抑制する中和抗体や受容体阻害薬を処置することによって、痛みが発症しないことを明らかにしました。さらに、本病態の形成に重要な三叉神経脊髄路核尾側亜核におけるミクログリアの活性化などの病理変化も抑制されることがわかりました (Molecules, 2021)。また、この慢性疼痛の発症抑制効果には雌雄差がなく、性別に関係なく治療効果を発揮することが期待できます (Biol Pharm Bull, 2024)。歯科治療時には、レントゲン撮影から神経損傷リスクを有する患者を確認することができます。従って、そのような患者には HMGB1 機能を抑制する薬物を前処置することによって、本疼痛病態の発症を予防できる可能性が期待されます。現在は薬理学的手法を用いて、HMGB1の標的受容体の探索を行なっています。本研究のさらなる発展は、三叉神経ニューロパチーの病態理解を深めるだけでなく、これまでにない治療標的の同定につながるものと考えられます。
パーキンソン病 と HMGB1
パーキンソン病は、中脳黒質ドパミン神経の脱落によって生じる神経変性疾患です。主症状は、振戦などの運動機能障害ですが、副症状として疼痛が生じることも報告されています。そこで、ドパミン神経の細胞死に伴う HMGB1の漏出が疼痛発症の重要な因子となる可能性に着目しました。また、本研究では、中和抗体が血液脳関門を通過しにくいことから、高い中枢移行性が知られている鼻腔からの薬物投与を行いました。その結果、HMGB1 中和抗体の経鼻投与は、パーキンソン病モデルマウスで確認される疼痛症状を抑制する効果が確認されました。一方で、ドパミン神経の脱落や、運動機能障害には効果を示しませんでした (Biomed Pharmacother., 2022)。疼痛は、パーキンソン病の治療意欲を減弱させるだけでなく、うつ症状や認知機能障害などへ発展させることも考えられます。本知見の応用によって、患者さんを疼痛から解放し、生活の質を高めることができると考えられます。
以上のことから、慢性疼痛時においてHMGB1は様々な領域において増加し、痛みの惹起に関与していることが分かりました。よってHMGB1自身や、その受容体を標的とした創薬により、新たな鎮痛薬化発に繋がる可能性が期待できます。
三叉神経ニューロパチー と HMGB1
三叉神経ニューロパチーは、親知らずの抜歯などの歯科治療時に、三叉神経の損傷によって誘発される慢性疼痛です。現在、有効な治療法は存在しておらず、新たな治療薬・治療戦略の開発が課題となっています。我々は、三叉神経が物理的に損傷される際に、HMGB1 が細胞外へ漏出し慢性疼痛を発症させるトリガーとなる可能性に着目しました。各種検討の結果、神経損傷直前にHMGB1機能を抑制する中和抗体や受容体阻害薬を処置することによって、痛みが発症しないことを明らかにしました。さらに、本病態の形成に重要な三叉神経脊髄路核尾側亜核におけるミクログリアの活性化などの病理変化も抑制されることがわかりました (Molecules, 2021)。また、この慢性疼痛の発症抑制効果には雌雄差がなく、性別に関係なく治療効果を発揮することが期待できます (Biol Pharm Bull, 2024)。歯科治療時には、レントゲン撮影から神経損傷リスクを有する患者を確認することができます。従って、そのような患者には HMGB1 機能を抑制する薬物を前処置することによって、本疼痛病態の発症を予防できる可能性が期待されます。現在は薬理学的手法を用いて、HMGB1の標的受容体の探索を行なっています。本研究のさらなる発展は、三叉神経ニューロパチーの病態理解を深めるだけでなく、これまでにない治療標的の同定につながるものと考えられます。
パーキンソン病 と HMGB1
パーキンソン病は、中脳黒質ドパミン神経の脱落によって生じる神経変性疾患です。主症状は、振戦などの運動機能障害ですが、副症状として疼痛が生じることも報告されています。そこで、ドパミン神経の細胞死に伴う HMGB1の漏出が疼痛発症の重要な因子となる可能性に着目しました。また、本研究では、中和抗体が血液脳関門を通過しにくいことから、高い中枢移行性が知られている鼻腔からの薬物投与を行いました。その結果、HMGB1 中和抗体の経鼻投与は、パーキンソン病モデルマウスで確認される疼痛症状を抑制する効果が確認されました。一方で、ドパミン神経の脱落や、運動機能障害には効果を示しませんでした (Biomed Pharmacother., 2022)。疼痛は、パーキンソン病の治療意欲を減弱させるだけでなく、うつ症状や認知機能障害などへ発展させることも考えられます。本知見の応用によって、患者さんを疼痛から解放し、生活の質を高めることができると考えられます。
以上のことから、慢性疼痛時においてHMGB1は様々な領域において増加し、痛みの惹起に関与していることが分かりました。よってHMGB1自身や、その受容体を標的とした創薬により、新たな鎮痛薬化発に繋がる可能性が期待できます。
・慢性疼痛における核内受容体REV-ERBsとRORγ
.jpg)
時計遺伝子である一つであるREV-ERBsがC6グリオーマ細胞(アストロサイト細胞株)における炎症性物質産生の制御に関与していることを明らかにした(Biochem. Biophys. Res. Commun., 2016)ことから、REV-ERBs活性を制御する薬物が新たな鎮痛薬となる可能性に着目しました。その結果、実験的に活性化させたアストロサイトからの痛み誘発物質の産生が、REV-ERBs刺激薬により抑制されることを明らかにしました。また坐骨神経痛、炎症性疼痛、糖尿病性疼痛、抗がん薬誘発性疼痛を誘発したそれぞれのモデルマウスに対して、REV-ERBs刺激薬を投与すると痛みが緩和されました。さらに、この鎮痛効果は、脊髄アストロサイトを抑制することで、それらからの痛み誘発物質の産生を低下させることに起因することを発見しました(2019年2月21日付の日刊工業新聞に掲載、Brain, Behav., and Immun., 2019、図3)。また最近、REV-ERBsによりミクログリア活性も抑制的に制御されており、この作用もREV-ERBs刺激薬による鎮痛効果に関わっていることが明らかとなっています(Neurochem. Int., 2021)。
最近、同じ時計遺伝子であり、核内受容体でもあるretinoic acid related orphan receptor γ (RORγ)がミクログリアの制御を介して痛みの制御に関わっていることを見出しました。神経障害性疼痛及び炎症性疼痛モデルマウスに対してRORγ阻害薬を投与すると、ミクログリアを抑制し、痛み誘発物質の産生を低下させることで、痛みを緩和する作用を示すことを明らかにしています(Neuroscience, 2024)。さらに、三叉神経ニューロパチーに対してもRORγ阻害薬が免疫細胞の一つであるマクロファージを抑制することで、鎮痛効果を示すことを見出しています(投稿準備中)。
従来、単一の痛み誘発物質を標的とする薬剤が鎮痛薬として注目されてきましたが、痛みシグナルの促進には様々な物質が関与するため、その効果は限定的でした。一方で、REV-ERBs刺激薬やRORγ阻害薬は、“痛みシグナル促進の元凶”となっているアストロサイトやミクログリアを抑制し、さらにそれらから産生される複数の痛み誘発物質を減少させるため、鎮痛薬として有効性が高く、応用性にも優れている可能性があります。
最近、同じ時計遺伝子であり、核内受容体でもあるretinoic acid related orphan receptor γ (RORγ)がミクログリアの制御を介して痛みの制御に関わっていることを見出しました。神経障害性疼痛及び炎症性疼痛モデルマウスに対してRORγ阻害薬を投与すると、ミクログリアを抑制し、痛み誘発物質の産生を低下させることで、痛みを緩和する作用を示すことを明らかにしています(Neuroscience, 2024)。さらに、三叉神経ニューロパチーに対してもRORγ阻害薬が免疫細胞の一つであるマクロファージを抑制することで、鎮痛効果を示すことを見出しています(投稿準備中)。
従来、単一の痛み誘発物質を標的とする薬剤が鎮痛薬として注目されてきましたが、痛みシグナルの促進には様々な物質が関与するため、その効果は限定的でした。一方で、REV-ERBs刺激薬やRORγ阻害薬は、“痛みシグナル促進の元凶”となっているアストロサイトやミクログリアを抑制し、さらにそれらから産生される複数の痛み誘発物質を減少させるため、鎮痛薬として有効性が高く、応用性にも優れている可能性があります。
変形性膝関節症における REV-ERBs
変形性関節症は加齢に伴って発症リスクが高まることから、高齢社会を迎え患者数が益々増加すると予想されます。変形性関節症の中で最も患者数が多いのが変形性膝関節症であり、その主訴は関節破壊など病態の進行に伴う慢性的な疼痛です。変形性膝関節症の疼痛はQOLを低下し、高齢者の就労を妨げるなど社会的生産性の損失が非常に大きいです。痛みにはNSAIDsやステロイド、オピオイド等が用いられますが、その効果は十分ではなく、長期服用に伴う副作用も頻出します。また最終的な人工関節置換術によって関節の病態は改善されるものの、侵襲性が高いうえ、疼痛が残存する患者が約20-30%存在することが報告されています。よって、新しい作用機序をもつ鎮痛薬の開発が望まれている状況です。
我々は変形性膝関節症の動物モデルならびに膝関節の軟骨細胞を用いて、鎮痛薬の新たな創薬標的について研究を進めています(J. Pharmacol.Sci., 2023)。その中で、上述した核内受容体REV-ERBsが有望な創薬標的となる可能性を見出しました(Int. Immunopharmacol., 2024)。変形性膝関節症モデルに対して、REV-ERBs刺激薬を膝関節内に投与することで、痛みが緩和されるとともに関節軟骨の破壊が一部抑制されることが明らかになりました。また膝関節由来の軟骨細胞を用いて、人為的に炎症を生じさせると様々な炎症性物質(炎症性サイトカインや軟骨基質分解酵素など)の発現が増加しましたが、これらの反応はREV-ERB刺激薬により抑制されることを明らかにしました(2023年12月29日付の日刊工業新聞掲載)。
・慢性疼痛における気分障害・認知機能障害
痛みによる不快情動は、生体警告系の役割を担う面では重要ですが、持続的な痛みに起因する不快情動は、QOL低下のみならず、精神疾患発症の引き金にもなることが知られています。実際に、慢性疼痛患者において、うつ病・不安症などの気分障害や認知機能障害が発症する割合が高いことが報告されています。一方で、精神疾患が痛みを増悪させることも知られていることから、悪循環が生じて疼痛が慢性化・複雑化し治療を困難にしていると考えられています。したがって、痛みの感覚面だけでなく情動面にも考慮した慢性疼痛治療の必要性、さらには、その基盤となる基礎的知見の集積が求められています。我々は、行動薬理学的手法や免疫組織化学的手法といった様々な実験技術を用いて、脳における炎症免疫機構に関わるグリア細胞(アストロサイト、ミクログリア)の役割に着目しつつ、慢性疼痛と気分障害または認知機能障害に共通する病態基盤を明らかにし、新たな治療薬創製に向けた研究を行っています。最近の研究成果から、神経障害性疼痛モデル動物において、坐骨神経障害後2週間から認知機能障害が生じ、坐骨神経障害後8週間で、不安・うつ様行動などが生じることを明らかにしました。そのメカニズムとして海馬や前帯状皮質におけるHMGB1によるミクログリアの活性化が関与することを明らかにしました(Prog Neuropsychopharmacol Biol Psychiatry., 2019; Exp Neurol., 2022)。海馬ミトコンドリア機能障害に伴うI型IFNの増加が神経障害性疼痛モデルマウスで認められる不安・うつ様行動に関与することも明らかにしました(Exp Neurol., 2023)。また、坐骨神経障害誘発性認知機能障害にはHMGB1やIL-6シグナルによる海馬神経細胞の可塑的な変化が関与し(Exp Neurol., 2022; Int Immunopharmacol., 2022)、このことには海馬ミクログリアが重要な役割を果たすことを明らかにしました(Behav Brain Res., 2025)。今後は、神経障害性疼痛の発症に関与するミクログリアの特性や神経可塑性との関連について詳細に検討を進めていく予定です。
また、慢性疼痛や気分障害の治療に用いられる抗うつ薬のグリア細胞における薬理作用についても研究を行っています(J. Cell. Physiol., 2021; Biochem Biophys Res Commun., 2021; Eur J Pharmacol., 2022)。気分障害の原因のひとつであるストレスに関連するホルモンであるグルココルチコイドがアストロサイトやミクログリアからのHMGB1放出を誘導することを明らかにし、グルコルチコイドが中枢神経系の慢性炎症に関与している可能性を示唆しました(Cells, 2020; Neuroscience, 2024)。
また、慢性疼痛や気分障害の治療に用いられる抗うつ薬のグリア細胞における薬理作用についても研究を行っています(J. Cell. Physiol., 2021; Biochem Biophys Res Commun., 2021; Eur J Pharmacol., 2022)。気分障害の原因のひとつであるストレスに関連するホルモンであるグルココルチコイドがアストロサイトやミクログリアからのHMGB1放出を誘導することを明らかにし、グルコルチコイドが中枢神経系の慢性炎症に関与している可能性を示唆しました(Cells, 2020; Neuroscience, 2024)。
2) ミクログリアの細胞老化が中枢神経機能へ及ぼす影響
脳内のミクログリアは、細胞分裂とアポトーシスのバランスによって細胞数を維持しています。加齢に伴う、この繰り返しはミクログリアのテロメアを短縮させ、細胞分裂限界に起因する細胞老化 (複製老化) を誘導することが近年報告されました。また、細胞老化は細胞老化関連分泌形質(Senescence-Associated Secretory Phenotype: SASP) となり、炎症性サイトカインなどを遊離することが知られており、ミクログリアの細胞老化による機能変調が老年期中枢神経疾患の発症・増悪に寄与する可能性が考えられますが、その詳細は不明です。そこで、細胞老化ミクログリアの培養系の確立 (第142回日本薬理学会近畿部会, 2022) や、自然老化マウスを用いて細胞老化ミクログリアが情動変化や認知機能障害、疼痛の病態形成への関与などを解析しています。